Jelaskan struktur atom menurut model Bohr dan berikan contoh unsur beserta konfigurasi elektronnya. Menentukan struktur atom
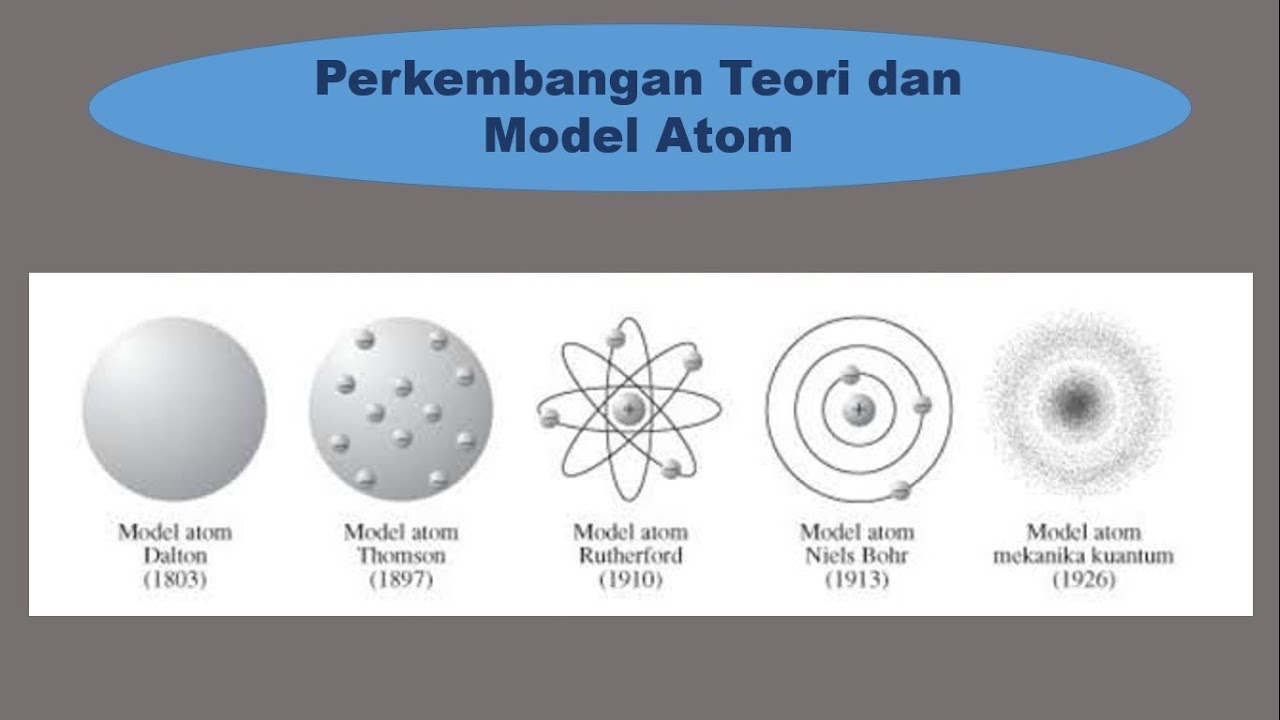
Dalam dunia ilmu pengetahuan, salah satu hal yang menarik untuk dipelajari adalah struktur atom. Atom adalah partikel terkecil dari suatu unsur yang masih dapat mempertahankan sifat-sifat kimianya. Salah satu teori yang digunakan untuk menggambarkan struktur atom adalah Model Atom Bohr. Model Atom Bohr dikembangkan oleh Niels Bohr pada tahun 1913 dan menjadi dasar dalam menggambarkan mekanisme konfigurasi elektron dalam suatu atom.
Model Atom Bohr Sebagai Dasar Dalam Menggambarkan Mekanisme Konfigurasi
Seperti yang terlihat dalam gambar di atas, Model Atom Bohr menunjukkan bahwa atom terdiri dari inti atom yang bermuatan positif dan elektron yang berputar mengelilingi inti atom dalam orbit tertentu. Inti atom terdiri dari proton yang bermuatan positif dan neutron yang tidak mempunyai muatan. Muatan positif proton dalam inti atom seimbang dengan muatan negatif elektron yang berada di luar inti atom.

Model Atom Bohr menjelaskan bahwa elektron dalam atom hanya dapat berada dalam orbit-orbit tertentu yang disebut dengan tingkat energi. Setiap tingkat energi memiliki jumlah maksimum elektron yang dapat diisi. Jumlah maksimum elektron dalam suatu tingkat energi diatur oleh dua aturan, yaitu aturan Aufbau dan aturan Hund. Aturan Aufbau menyatakan bahwa elektron akan mengisi tingkat energi terendah terlebih dahulu sebelum mengisi tingkat energi yang lebih tinggi. Sedangkan aturan Hund menyatakan bahwa saat mengisi tingkat energi yang sama, elektron akan terlebih dahulu mengisi setiap orbital dengan satu elektron sebelum mengisi dengan pasangan elektron.
Kelebihan Dan Kelemahan Teori Atom Modern
Dalam perkembangannya, Model Atom Bohr mengalami beberapa kelebihan dan kelemahan. Kelebihan dari Model Atom Bohr antara lain adalah dapat menjelaskan spektrum garis emisi dan absorpsi. Spektrum garis emisi adalah spektrum cahaya yang dihasilkan ketika elektron dalam suatu atom berpindah dari tingkat energi yang lebih tinggi ke tingkat energi yang lebih rendah. Sedangkan spektrum garis absorpsi adalah spektrum cahaya yang dihasilkan ketika atom menyerap cahaya dengan energi yang sesuai untuk mengangkat elektron dari tingkat energi yang rendah ke tingkat energi yang lebih tinggi.

Selain itu, Model Atom Bohr juga dapat menjelaskan sifat-sifat kimia unsur. Sifat-sifat kimia unsur, seperti kemampuan membentuk senyawa, dapat dijelaskan melalui konfigurasi elektron dalam atom. Jumlah elektron dalam kulit terluar atom menentukan sifat-sifat kimia unsur. Hal ini sesuai dengan aturan Aufbau dan aturan Hund yang dijelaskan sebelumnya.
Namun, Model Atom Bohr juga memiliki kelemahan. Salah satu kelemahan Model Atom Bohr adalah tidak dapat menjelaskan fenomena-fenomena kuantum yang terjadi pada tingkat atom yang lebih kecil. Model Atom Bohr tidak dapat menjelaskan pengelompokan spektrum garis emisi dan absorpsi pada unsur-unsur lain. Oleh karena itu, Model Atom Bohr perlu diperbarui dan dikembangkan lebih lanjut.
Materi Model Atom Niels Bohr dan Konfigurasi Elektron - RPP 1 LEMBAR
Perkembangan lebih lanjut terjadi pada tahun 1926 ketika Erwin Schrödinger mengembangkan persamaan gelombang untuk menjelaskan sifat-sifat partikel-partikel subatomik seperti elektron. Persamaan gelombang Schrödinger ini menjadi dasar bagi perkembangan teori Atom Modern. Teori Atom Modern dapat menjelaskan fenomena-fenomena kuantum yang tidak dapat dijelaskan oleh Model Atom Bohr.

Mahasiswa atau siswa yang belajar tentang konfigurasi elektron dalam atom perlu mengetahui bagaimana cara menentukan konfigurasi elektron berdasarkan tingkat energi dan hukum-hukum yang berlaku. Salah satu cara untuk menentukan konfigurasi elektron adalah dengan menggunakan prinsip Aufbau, prinsip Hund, dan prinsip Pauli.
Prinsip Aufbau menyatakan bahwa tingkat energi yang lebih rendah harus diisi terlebih dahulu sebelum masuk ke tingkat energi yang lebih tinggi. Dalam Proses ini, elektron akan masuk ke dalam orbital-orbital yang tersedia dengan urutan sesuai aturan Aufbau. Elektron dalam orbital yang sama akan terlebih dahulu terisi satu per satu sebelum pasangan elektron terbentuk.
Prinsip Pauli menyatakan bahwa dalam suatu atom, tidak ada dua elektron yang memiliki keempat bilangan kuantum yang sama. Oleh karena itu, setiap orbital hanya dapat diisi oleh dua elektron dengan spin berlawanan. Sebagai contoh, ketika mempelajari konfigurasi elektron atom karbon (C), kita masukkan elektron pertama ke dalam orbital 1s, kemudian isi sisa ruang dengan elektron yang memiliki spin berlawanan, yaitu 2s dan 2p.
Menentukan Struktur Atom - ujiansma.com
Selain itu, prinsip Hund juga harus diperhatikan dalam menentukan konfigurasi elektron. Prinsip Hund menyatakan bahwa saat mengisi orbital-orbital yang memiliki tingkat energi yang sama, elektron akan lebih cenderung mengisi setiap orbital terlebih dahulu dengan satu elektron sebelum membentuk pasangan elektron. Hal ini disebabkan oleh repulsi antar elektron yang cenderung lebih rendah saat elektron berada di orbital yang berbeda.

Untuk memahami konfigurasi elektron yang lebih kompleks, seperti pada unsur dengan nomor atom yang lebih tinggi, kita perlu mengetahui urutan pengisian subkulit elektron sesuai dengan aturan Aufbau. Urutan pengisian subkulit elektron adalah sebagai berikut:
Pertanyaan:
1. Apa yang dimaksud dengan Model Atom Bohr?
2. Apa kelebihan Model Atom Bohr dalam menggambarkan spektrum garis emisi dan absorpsi?
3. Apa kelemahan Model Atom Bohr?
4. Apa yang dimaksud dengan Teori Atom Modern?
5. Bagaimana cara menentukan konfigurasi elektron dalam suatu atom?
Jawaban:
1. Model Atom Bohr adalah salah satu model atom yang menjelaskan bahwa atom terdiri dari inti atom yang bermuatan positif dan elektron yang berputar mengelilingi inti atom dalam orbit tertentu. Model Atom Bohr dikembangkan oleh Niels Bohr pada tahun 1913.
2. Kelebihan dari Model Atom Bohr adalah dapat menjelaskan spektrum garis emisi dan absorpsi. Spektrum garis emisi adalah spektrum cahaya yang dihasilkan ketika elektron dalam suatu atom berpindah dari tingkat energi yang lebih tinggi ke tingkat energi yang lebih rendah. Sedangkan spektrum garis absorpsi adalah spektrum cahaya yang dihasilkan ketika atom menyerap cahaya dengan energi yang sesuai untuk mengangkat elektron dari tingkat energi yang rendah ke tingkat energi yang lebih tinggi.
3. Kelemahan Model Atom Bohr adalah tidak dapat menjelaskan fenomena-fenomena kuantum yang terjadi pada tingkat atom yang lebih kecil. Model Atom Bohr tidak dapat menjelaskan pengelompokan spektrum garis emisi dan absorpsi pada unsur-unsur lain.
4. Teori Atom Modern adalah perkembangan lebih lanjut dari Model Atom Bohr yang dapat menjelaskan fenomena-fenomena kuantum yang tidak dapat dijelaskan oleh Model Atom Bohr. Teori Atom Modern didasarkan pada persamaan gelombang Schrödinger yang menjelaskan sifat-sifat partikel-partikel subatomik seperti elektron.
5. Cara menentukan konfigurasi elektron dalam suatu atom adalah dengan menggunakan prinsip Aufbau, prinsip Hund, dan prinsip Pauli. Prinsip Aufbau menyatakan bahwa tingkat energi yang lebih rendah harus diisi terlebih dahulu sebelum masuk ke tingkat energi yang lebih tinggi. Prinsip Hund menyatakan bahwa saat mengisi orbital-orbital yang memiliki tingkat energi yang sama, elektron akan lebih cenderung mengisi setiap orbital terlebih dahulu dengan satu elektron sebelum membentuk pasangan elektron. Prinsip Pauli menyatakan bahwa dalam suatu atom, tidak ada dua elektron yang memiliki keempat bilangan kuantum yang sama.
Struktur Atom Dan Perkembangan Model Atom Seputar Model My Xxx Hot Girl
Perkembangan model atom tidak terhenti pada Model Atom Bohr dan Teori Atom Modern. Selanjutnya, ditemukan model-model atom yang lebih kompleks dan dapat menjelaskan fenomena-fenomena kuantum dengan lebih baik. Salah satu model atom yang lebih kompleks adalah Model Atom Kuantum atau Model Orbital. Model Atom Kuantum dikembangkan oleh Paul Dirac dan Erwin Schrödinger pada tahun 1920-an.
Model Atom Kuantum atau Model Orbital menyatakan bahwa elektron dalam atom tidak bergerak dalam orbit melainkan berada dalam wilayah yang disebut orbital. Orbital adalah ruang di sekitar inti atom di mana terdapat kemungkinan tinggi untuk menemukan elektron. Setiap orbital mempunyai bentuk dan energi tertentu yang merupakan solusi dari persamaan gelombang Schrödinger.
Model Atom Kuantum memperkenalkan konsep sumbu kuantum, bilangan kuantum magnetik, dan spin elektron. Sumbu kuantum adalah arah pergerakan orbital dalam tiga dimensi, sedangkan bilangan kuantum magnetik menunjukkan jumlah kemungkinan arah rotasi orbital. Spin elektron adalah sifat intrinsik yang dimiliki oleh elektron dan dapat berupa spin atas (up) atau spin bawah (down).
Jelaskan Bagaimana Bunyi Postulat Bohr Dalam Menjelaskan Teorinya
Bunyi Postulat Bohr dalam menjelaskan teorinya adalah sebagai berikut:

- Elektron dalam atom hanya dapat berada dalam orbit-orbit tertentu dengan tingkat energi yang tetap.
- Saat berada dalam orbit tertentu, elektron tidak mengalami perubahan energi maupun pemancaran radiasi elektromagnetik.
- Ketika elektron berpindah dari orbit yang lebih rendah ke orbit yang lebih tinggi, energi yang diterima oleh elektron sama dengan selisih energi antara dua orbit tersebut.
- Ketika elektron berpindah dari orbit yang lebih tinggi ke orbit yang lebih rendah, energi yang dilepaskan oleh elektron sama dengan selisih energi antara dua orbit tersebut.
- Orbital-orbital dalam atom hanya dapat diisi oleh maksimal dua elektron dengan arah spin yang berlawanan.
- Elektron dapat berpindah dari satu orbit ke orbit lainnya jika menerima atau melepaskan energi yang sama dengan selisih energi antara dua orbit tersebut. Proses ini disebut sebagai transisi elektronik.
Tingkat Tingkat Energi Atom Hidrogen Menurut Model Atom Bohr Disebut
Tingkat energi atom hidrogen menurut Model Atom Bohr disebut dengan orbit. Dalam Model Atom Bohr, atom hidrogen hanya memiliki satu elektron yang berputar mengelilingi inti atom. Elektron tersebut dapat berada dalam orbit-orbit dengan tingkat energi yang berbeda-beda.

Tingkat energi atom hidrogen menurut Model Atom Bohr ditentukan oleh bilangan kuantum utama (n). Bilangan kuantum utama (n) menentukan energi tingkat yang dihasilkan oleh tingkat energi ini. Semakin tinggi bilangan kuantum utama (n), semakin tinggi tingkat energinya.
Pada Model Atom Bohr, orbit yang paling dalam atau tingkat energi terendah memiliki bilangan kuantum utama (n) yang nilain
Post a Comment for "Jelaskan struktur atom menurut model Bohr dan berikan contoh unsur beserta konfigurasi elektronnya. Menentukan struktur atom"